Borfluorsyre som katalysator: Anvendelser og mekanismer i borfluoridsaltdannelse
Borfluorsyre (HBF4) er en meget reaktiv uorganisk syre, der spiller en vigtig rolle i moderne kemi og industri. Når det bruges som katalysator, HBF4 letter en lang række reaktioner, især dem, der involverer dannelsen af borfluoridsalte, en klasse af forbindelser, der er nyttige i forskellige industrielle anvendelser. I denne artikel vil vi udforske de specifikke anvendelser af borfluorsyre som katalysator, dens rolle i at lette kemiske reaktioner og de underliggende mekanismer, der gør den til en så alsidig og effektiv katalysator.
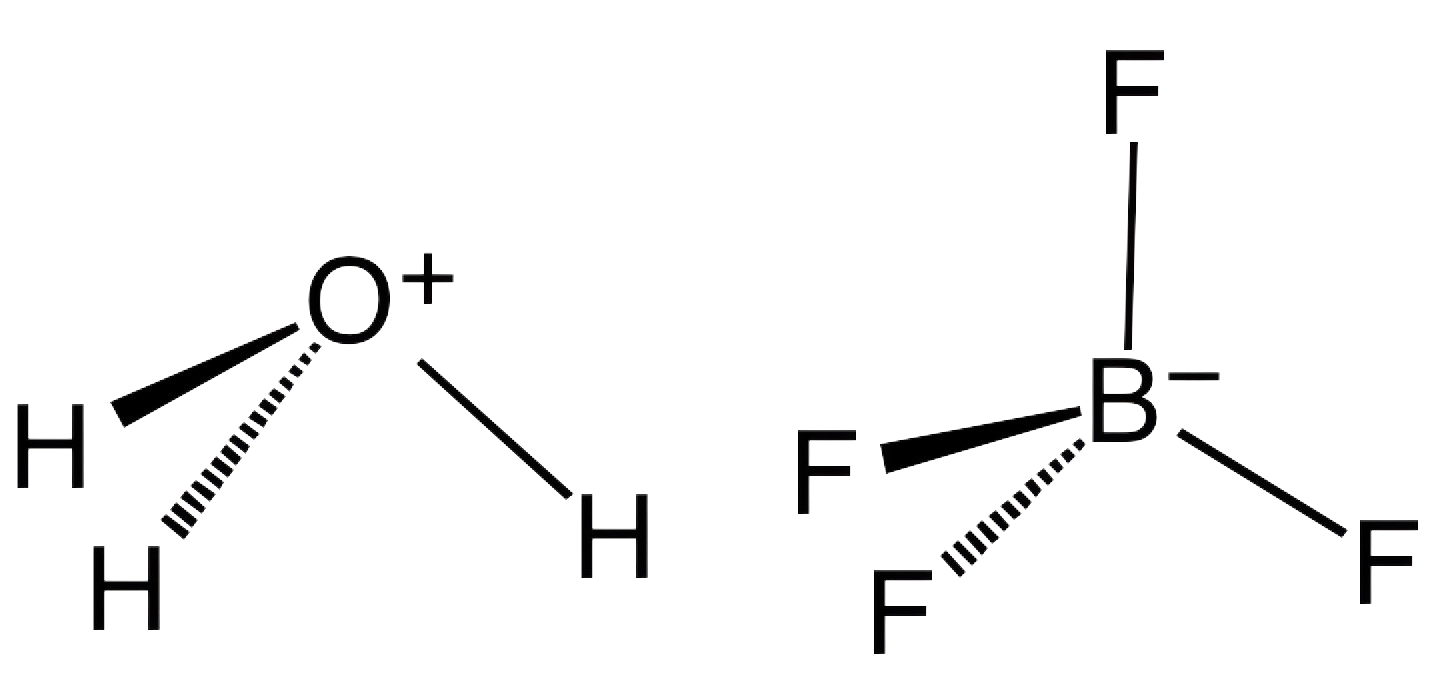
1. Hvad er borfluorsyre, og hvordan fungerer det som katalysator?
Borfluorsyre, med den kemiske formel HBF4, er en forbindelse bestående af hydrogen, bor og fluor. Det er en stærk syre, der dissocierer i opløsning for at frigive en proton (H+) og tetrafluorborat-anionen (BF4-). Den unikke kombination af bor og fluor i dets struktur giver det distinkte katalytiske egenskaber, især i reaktioner, hvor fluorbaserede arter eller borkemi er involveret.
Som en katalysator fungerer borfluorsyre ved at fremme visse kemiske reaktioner uden at blive forbrugt i processen. Det kan aktivere molekyler ved at donere protoner (fungere som en Brønsted-syre) eller ved at acceptere elektronpar (fungere som en Lewis-syre). Disse egenskaber gør HBF4 især nyttig i forskellige reaktioner, herunder dannelsen af borfluoridsalte, som har brede industrielle anvendelser.
2、Anvendelser af borfluorsyre som katalysator
2.1 Dannelse af borfluoridsalte
En af de mest almindelige anvendelser af borfluorsyre er i syntesen af borfluoridsalte, såsom natriumtetrafluorborat (NaBF)4), kaliumtetrafluorborat (KBF4) og ammoniumtetrafluorborat (NH4BF4). Disse salte er afgørende i flere kemiske processer og dannes ved at neutralisere borfluorsyre med en passende base. Den generelle reaktion er som følger:
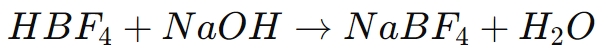
I denne proces donerer borfluorsyre en proton til basen, danner vand og efterlader tetrafluorboratanionen (BF)4-), som derefter associerer med metalionen (f.eks. Na+) til dannelse af et borfluoridsalt.
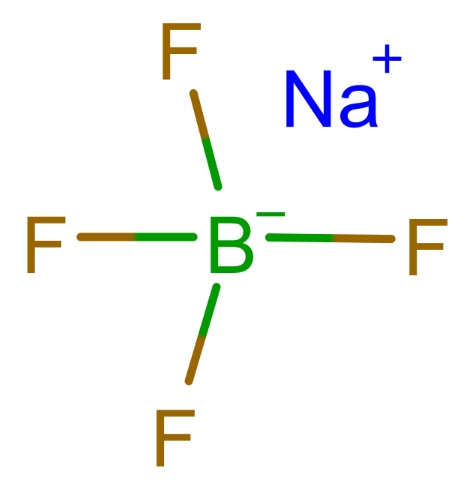
Disse borfluoridsalte bruges på forskellige områder, herunder:
● Elektrokemi:Anvendes som elektrolytter i lithium-ion-batterier og galvaniseringsprocesser.
● Polymerkemi: Fungere som initiatorer i polymerisationsreaktioner.
● Fluorering: Bruges til at indføre fluoratomer i organiske forbindelser, hvilket øger deres stabilitet og reaktivitet.
2.2 Organisk syntese og katalyse
Borfluorsyre spiller også en kritisk rolle i organisk syntese, især i aktiveringen af elektrofile reagenser. Når det bruges som katalysator, HBF4 kan accelerere reaktioner såsom Friedel-Crafts alkylering, acylering og andre elektrofile substitutionsreaktioner. Mekanismen involverer typisk Lewis-syreegenskaberne af HBF4, hvor det koordinerer med elektronrige arter, hvilket øger deres reaktivitet og fremmer dannelsen af nye bindinger.
For eksempel iFriedel-Crafts alkylering, HBF₄aktiverer alkylhalogenider, hvilket letter tilføjelsen af alkylgrupper til aromatiske ringe. Den generelle reaktion for en sådan proces er:
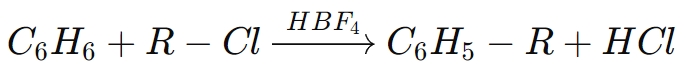
I denne reaktion virker borfluorsyre som en katalysator for at lette alkyleringen af benzen med et alkylchlorid, hvilket producerer en alkyleret aromatisk forbindelse.
2.3 Polymerisation og oligomerisering
HBF4 er også en effektiv katalysator til polymerisationsreaktioner. Det bruges især til at initiere polymerisationen af styren og andre monomerer, hvilket fører til dannelsen af værdifulde polymermaterialer som polystyren. Borfluorsyre kan aktivere dobbeltbindingen i monomeren, hvilket muliggør vækst af polymerkæder og dannelse af polymeren.
For eksempel i polymerisationen af styren (C8H8):
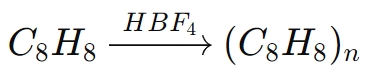
I denne reaktion, HBF4initierer polymerisationen ved at donere en proton til styrenmolekylet, hvilket genererer en reaktiv carbocation, som derefter formerer polymerkæden.
Desuden kan borfluorsyre katalysereoligomerisering, processen hvor små molekyler (oligomerer) danner længere kæder uden fuld polymerisation. Dette er vigtigt i produktionen af specialiserede materialer, der anvendes i belægninger og klæbemidler.
2.4 Elektrokemiske og batteriapplikationer
Inden for elektrokemi er borfluorsyre i vid udstrækning brugt til at skabe borfluoridsalte, der tjener som elektrolytter i lithium-ion og andre typer batterier. Brugen af borfluoridsalte i batterier forbedrer deres ioniske ledningsevne og stabilitet, hvilket gør dem særdeles velegnede til brug i energilagringssystemer.
For eksempel lithiumtetrafluorborat (LiBF4) bruges almindeligvis som en elektrolyt i lithium-ion-batterier på grund af dens høje ioniske ledningsevne og stabilitet ved høje spændinger.
Borfluorsyres rolle i elektrokemiske processer strækker sig til metalgalvanisering, hvor borfluoridsalte fungerer som elektrolytopløsninger, der letter aflejringen af metaller som kobber, guld og tin. Brugen af borfluorsyre i denne sammenhæng hjælper med at skabe mere ensartede belægninger på metaller, hvilket gør det til en væsentlig komponent i industrier som elektronik og metalbearbejdning.
2.5 Fluorering af organiske forbindelser
En anden væsentlig anvendelse af borfluorsyre som katalysator er i fluoreringsreaktioner. Evnen til at inkorporere fluoratomer i organiske molekyler er værdifuld i produktionen af lægemidler, agrokemikalier og specialmaterialer. Borfluorsyre kan aktivere fluorkilder, såsom fluorgas eller fluorholdige forbindelser, hvilket gør dem i stand til at reagere med organiske substrater.
For eksempel ved fluorering af en organisk forbindelse (RX):
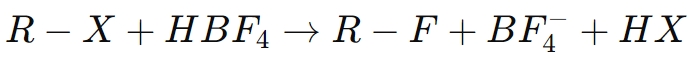
Her hjælper borfluorsyre med at lette substitutionen af et halogenatom med fluor, hvilket forbedrer egenskaberne af den resulterende forbindelse, såsom dens kemiske stabilitet og modstandsdygtighed over for nedbrydning.
3、Katalysemekanisme af borfluorsyre
Den katalytiske aktivitet af borfluorsyre kan forklares ved dens evne til at fungere som både enBrønsted acid og enLewis-syre:
● Brønsted Acid: Som protondonor kan borfluorsyre protonere substrater, hvilket øger deres elektrofilicitet og gør dem mere reaktive i efterfølgende reaktioner. Dette er især nyttigt i reaktioner som nukleofil substitution, hvor en elektronrig nukleofil angriber et elektrofilt substrat.
● Lewis-syre: Borfluorsyre fungerer som en Lewis-syre ved at acceptere elektronpar fra nukleofile arter, hvorved elektrofiler aktiveres og forskellige substitutions- og additionsreaktioner faciliteres. Dette er især tydeligt i reaktioner som Friedel-Crafts alkylering, hvor HBF4 koordinerer med alkylhalogenider, hvilket gør dem mere reaktive med aromatiske forbindelser.
Gennem disse mekanismer kan borfluorsyre sænke aktiveringsenergien af reaktioner, øge reaktionshastigheder og forbedre udbyttet af ønskede produkter.
4、Fordele og udfordringer ved at bruge borfluorsyre
4.1 Fordele
● Effektivitet:Borfluorsyre accelererer reaktioner ved at sænke aktiveringsenergien, hvilket resulterer i hurtigere reaktionstider og højere udbytter.
● Selektivitet: Dens stærke sure egenskaber sikrer, at kun specifikke substrater aktiveres, hvilket giver høj selektivitet i komplekse reaktioner.
● Alsidighed: Det kan bruges i en lang række reaktioner, herunder organisk syntese, polymerisation og elektrokemiske processer.
4.2 Udfordringer
● Ætsende: På grund af sin stærke sure natur er borfluorsyre stærkt ætsende og kræver specialiseret håndtering og udstyr.
● Miljøpåvirkning: Som en fluorholdig forbindelse skal borfluorsyre og dens derivater bortskaffes omhyggeligt for at undgå miljøforurening.
● Omkostninger: Produktionen og oprensningen af borfluorsyre kan være dyr, hvilket begrænser dens anvendelse i store industrielle processer.
Borfluorsyre er en utrolig alsidig katalysator, der spiller en afgørende rolle i syntesen af borfluoridsalte, organisk syntese, polymerisation og elektrokemiske anvendelser. Dens evne til at fungere som både en Brønsted- og Lewis-syre gør den til et uundværligt værktøj i mange kemiske processer. Dens brug kræver dog omhyggelig håndtering på grund af dens ætsende natur og miljøpåvirkning. Med igangværende forskning og teknologiske fremskridt vil borfluorsyre sandsynligvis finde endnu flere anvendelser i forskellige industrier, hvilket driver innovation og effektivitet på tværs af en bred vifte af sektorer.




